Wissenschaftliche Belege
Wissenschaft
Professor Eberhard Weihe ist Autor oder Co-Autor
von 240 internationalen Publikationen aus dem Fachgebiet Hirn-Forschung
Experimentelle und klinische Daten sowie eigene Beobachtungen zu Fragen über Pathomechanismen der Migräne abseits des wissenschaftlichen Mainstreams gab es bereits 1990 in ausreichender Zahl und Kohärenz, der geringere Teil davon war unter „Migräne“ zu finden.
Nach diesen Daten schien es uns plausibel, extrakranielle Pathomechanismen für die Migräne in Erwägung zu ziehen, ohne dass wir wissen konnten, wie hoch ihr Stellenwert sein würde. Es war uns aber auch klar, dass der Sympathicus dabei möglicherweise eine Schlüsselrolle spielen würde.
Der wirksame therapeutische Zugriff konnte unserer Überzeugung nach in Abgrenzung zur systemisch pharmakologischen Symptombehandlung nur topisch-pharmakologisch gelingen unter Ausnutzung des neuro-neuronalen Organisations-Prinzips der Zielprojektion.
Unter Einbeziehung damaliger zellbiologischer Kenntnisse über Signal-Übertragung, -Verarbeitung und Antwort war uns bewusst, dass langfristig wirksame Behandlung nur möglich würde durch fortlaufende Repetition relevanter Signalmodulation. Die damals bereits bekannten Daten zur Informationsübertragung zwischen immunkompetenten Zellen und nozizeptiven Neuronen ließ die Wirksamkeit von Lokalanästhetika zur Signal-Unterbrechung unter einem neuen Gesichtswinkel erscheinen und ihren Einsatz als brauchbares therapeutisches Konzept.
Die Kenntnisse über Vorgänge im Mikro-Milieu, die Reaktionen des Mikromilieus auf die Expression von Neuropeptiden, Aufbau und Unterhaltung verschiedener Circulus vitiosi mit synergistischen pathologischen Effekten erzeugten schließlich die Gewissheit, dass der Zugriff auf mögliche extrakranielle Migräne-Mechanismen nicht nur Sinn macht, sondern auch einen höheren therapeutischen Stellenwert besitzen könnte, als zunächst zu vermuten war.
Die erworbenen Kenntnisse über die lege artis Durchführung neuronaler Signalblockaden sowie die Entwicklung eines speziellen pharmakologischen und technischen Infiltrations-Verfahrens erlaubten uns den Spagat zu wagen.
Seither musste nicht ein einziger Zwischenfall protokolliert werden.
Der dokumentierte langfristige klinische Erfolg bei der Behandlung schwerstbetroffener Migräniker scheint eine alte Weisheit zu bestätigen:
Wer heilt, *** hat Recht.
*** „Als Heilung bezeichnet man den biologischen Prozess der Rückbildung einer Erkrankung bzw. einer pathologischen Gewebsveränderung in Richtung des gesunden Ausgangszustands. Der Heilungsvorgang basiert auf körpereigenen Reparaturmechanismen, die durch Maßnahmen eines Therapeuten ermöglicht, unterstützt oder auch beschleunigt werden können.“
(Zitat aus „Deutsche Enzyklopädie“)
Wissenschaftliche Belege
Fragen
Die allgemein verbreitete Sicherheit über die trigemino-vaskuläre Pathogenese der Migräne, gestützt von unübersehbaren Fortschritten bei der Behandlung des akuten Anfalls durch Triptane, haben dazu geführt, dass eine Reihe diskreter Hinweise auf mögliche weitere pathogenetisch wirksame Mechanismen der Anfalls-Induktion weit-gehend unbeachtet blieben.
Die spontane Durchbrechung eines akuten Migräne-Anfalls durch Blockaden zervikaler oder thorakaler Grenzstrang-Ganglien [5,6] sowie die prophylaktische Wirksamkeit repetitiver Stellatum-Blockaden [11] legen die Vermutung nahe, dass Migräne-Anfälle entgegen allgemeiner Überzeugung, jedoch unter Zugrundelegung verfügbarer neuro-anatomischer und topografisch-anatomischer Daten mit Vorgängen im Bereich der Hals- oder Brustwirbelsäule [2,7,8] in Verbindung stehen könnten. Hierfür spricht auch die manual-therapeutische Beeinflussbarkeit frischer Migräne-Anfälle über die C1-Etage der Halswirbelsäule durch die Atlas-[Impuls-]Therapie nach ARLEN.
Die symptomatologische und neuroanatomische Abgrenzung des zervikogenen Kopfschmerzes von der Migräne [4,9,10] wirft in diesem Zusammenhang mehr Fragen auf, als dass die damit beabsichtigte Klarstellung klinische oder therapeutische Relevanz besäße.
Der häufig zu beobachtende Wandel von Migräne zu Spannungs-Kopfschmerz mit gleitenden Übergängen in zahllosen Varianten, die sich nach wie vor einer klaren Differenzierung nach den Kriterien der IHS-Klassifikation [3] entziehen [1], könnte als Indiz für gemeinsame Wurzeln beider Kopfschmerzformen interpretiert werden und Argumentation ihrer extrakraniellen Genese stützen.
1. Barolin GS: [Headache: classification/nomenclature]. Wien Med Wochenschr. 1994;144(5-6):93-9.
As the majority of 90% chronical headaches have a multifactorial etiology, these factors have to be taken into consideration one by one. Usually more than one is to be found. Such differential diagnosis forms already a clear way into differentiated therapy. The nowadays discussed IHS-classification we see contrarely to … the demands of a good classification.
2. Chung K, Chung JM, LaVelle FW, Wurster RD: Sympathetic neurons in the cat spinal cord projecting to the stellate ganglion. J Comp Neurol. 1979 May 1;185(1):23-9.
A wide range (C8-T8) of spinal cord levels projected to the stellate ganglia, with a peak at the T2 level.
3. Evers S: [The new IHS classification. Background and structure]. Schmerz. 2004 Oct;18(5):351-6.
In 1988 the first IHS version appeared, and this was revised in its current version in 2003. The classification is based on the description of the headache features and thus a phenomenological rather than an etiological classification. Some patients can have more than one headache diagnosis.
4. Frese A, Schilgen M, Husstedt IW, Evers S: [Pathophysiology and clinical manifestation of cervicogenic headache]. Schmerz 2003 Apr;17(2):125-30.
Cervicogenic headache can origin from different muscles and ligaments of the neck, from intervertebral discs,and, particularly, from the atlantooccipital, atlantoaxial, and C2/C3 zygapophyseal joints. Diagnosis of cervicogenic headache should adhere strictly to the published diagnostic criteria to avoid misdiagnosis and confusion with primary headache disorders such as migraine and tension type headache.
5. Harder HJ: [Treatment of migrain blanche and ophthalmique with blocks of the superior cervical ganglion. A positive study on 84 patients]. Anaesthesist. 1981 Jan;30(1):1-9.
About 30% of all patients who were given the first treatment in an acute stage became free of complaints within a few minutes.
6. Higa S: [Migraine and nerve block]. Nippon Rinsho. 2001 Sep;59(9):1717-21.
C2 root ganglion block therapy is the most efficacious treatment of the acute attack of migraine. Stellate ganglion block is a usefulness of amelioration of the sensory nerves of the intracranial vessels and prevention of migraine headache.
7. Nozdrachev AD, Jimenez B, Morales MA, Fateev MM: Neuronal organization and cell interactions of the cat stellate ganglion. Auton Neurosci. 2002 Jan 10;95(1-2):43-56.
Sympathetic preganglionic neurons of segments C8-T10 send their axons to the stellate ganglion. The right ganglion is larger than the left and contains more cells.
8. Pilowsky P, Llewellyn-Smith IJ, Minson J, Chalmers J: Sympathetic preganglionic neurons in rabbit spinal cord that project to the stellate or the superior cervical ganglion. Brain Res. 1992 Apr 17;577(2):181-8.
Sympathetic preganglionic neurons that projected to the stellate ganglion were located in spinal segments T1 to T10. Sympathetic preganglionic neurons projecting to the superior cervical ganglion were found in segments T1 to T8. Almost 95% of the neurons supplying the superior cervical ganglion had axons that passed through the stellate ganglion.
9. Pollmann W, Keidel M, Pfaffenrath V: Headache and the cervical spine: a critical review. Cephalalgia. 1997 Dec;17(8):801-16.
Primary headaches such as tension-type headache and migraine are incorrectly categorized as „cervicogenic“ merely because of their occipital localization. Ipsilateral blockades of the C2 root and/or greater occipital nerve allow a differentiation between cervicogenic headache and primary headache syndromes such as migraine or tension-type headache.
10. Sjaastad O, Bovim G: Cervicogenic headache. The differentiation from common migraine. An overview. Funct Neurol. 1991 Apr-Jun;6(2):93-100.
Typical migraine symptoms, such as nausea, vomiting, photophobia, and phonophobia also occur in cervicogenic headache, but less frequently and to a lesser degree. In our estimation, cervicogenic headache and common migraine are two distinct disorders, with their own clinical patterns, pathogenesis, treatment - and, in all probability, also prognosis.
11. Ullrich J: [Stellate ganglion block under EEG control in the treatment of complicated cervical migraine]. Neurol. 1975 Aug 1;209(4):301-6.
A transient amelioration of the pathological EEG pattern was observed after each stellate ganglion block and after several treatments the EEG was normal and the migraine attacks disappeared.
Wissenschaftliche Belege
Migräne
Nach unseren Erkenntnissen beruht die interindividuelle Vielfalt der Symptome einer Migräne auf individuell differenten, extrakraniellen Faktoren, die mehrheitlich auf primär topisch gesteigerte Aktivität des peripheren Sympathikus zurückzuführen sind. Dabei scheinen in erster Linie funktionelle Veränderungen gelenksnaher Strukturen der Wirbelsäule Disposition und Auslösung sympathischer Überaktivität zu dominieren.
Ursachenkette
Ort und Ausprägung funktioneller Veränderungen scheinen Ort und Ausprägung der intrakraniellen Veränderungen zu definieren und damit die Ausprägung der individuell weitgehend konstanten Anfalls-typischen Symptome einer Migräne.
Diese Beobachtungen stimmen mit den Prinzipien der interneuronalen Zielprojektion überein [8].
Danach werden primär afferente propriozeptive und nozizeptive somatische und viszerale Neurone auf spinaler Ebene durch spezifische Interneurone auf präganglionäre Neurone und in Grenzstrang-Ganglien auf postganglionäre sympathische Neurone zu spezifischen Zielorganen umgeschaltet [9,10,17]. Ein solches „Zielorgan“ kann auch die kurze Wegstrecke einer Arteriole sein [2].
Es ist bekannt, dass sich im Migräneanfall das zerebrale Blutverteilungsmuster ändert [12,21,22]. Die Änderungen beruhen auf primärer Vasokonstriktion sowie gegenregu-latorischer Vasodilatation [6] von Arteriolen und Kapillaren auf Wegstrecken von wenigen Millimetern Länge [7].
Entsprechend der interneuronalen Zielprojektion sind einer definierten Gefäßstrecke bestimmte, primär afferente Neurone eines definierten peripheren Gewebsareals zuzuordnen. Dabei kann jedes periphere Gewebe zielprojektiv wirksam sein: Gelenkskapseln, Ligamente, Muskeln, Sehnen oder auch Gewebe innerer Organe. So konnte nach noxischer Stimulation eines Ischias-Nervs ein signifikanter Rückgang des regionalen zerebralen Blutflusses [rCBF] im Bereich von Thalamus und Hypothalamus ipsilateral beobachtet werden, kontralateral war ein moderater Rückgang des rCBF zu verzeichnen [19].
Die Veränderung des regionalen Blutverteilungs-Musters im Migräne-Anfall geht demnach wohl nicht eine physiologische Aktivität der zentral-autonomen Regulation zurück im Sinne einer Anpassung an variable zerebrale Anforderungen, sondern erscheint als Ergebnis einer exogenen Störung mit der Folge dysregulatorischer Adaptation mit Auslösung neuro-immunologischer, neuro-histochemischer und neuro-neuronaler Reaktionskaskaden und Überlastung des endogenen anti-nozizeptiven Potenzials mit der Folge von Migräne-Schmerzen und Migräne- und Aura-spezifischen senso-motorischen, neuro-vegetativen, psycho-vegetativen und koordinativen Funktions-Störungen.
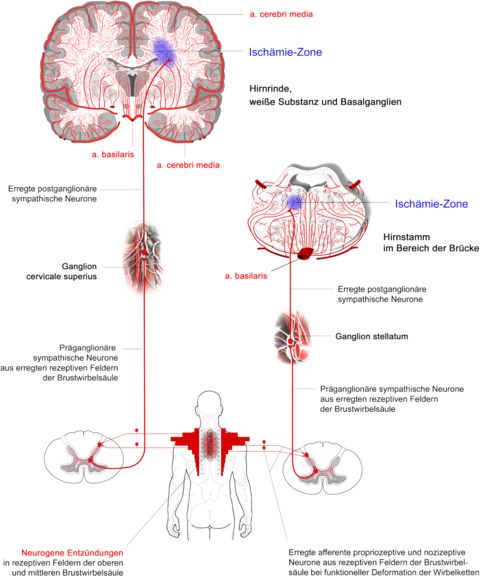
Die spinale interneuronale Informations-Verarbeitung beruht auf der neuro-anatomischen Konvergenz multimodaler sensorischer, primär afferenter Neurone [16]. Die Erregung präganglionärer sympathischer Neurone ist abhängig von Anzahl und Aktivität afferenter Neurone sowie deren interneuronaler Verarbeitung [3,14]. Für eine klinisch wirksame symptom-auslösende bzw. symptom-modulierende intrazerebrale Vasokonstriktion kommen vor allem solche Gewebe in Betracht, die über eine hohe Dichte afferenter Neurone mit einer signifikanten Rezeptorendichte verfügen und in denen nennenswerte Zahlen präganglionärer sympathischer Neurone gefunden wurden. Die obere Brustwirbelsäule nimmt hierin eine Sonderstellung ein [4,5,11,13,17,18,23,24].
Wir haben beoachtet, dass funktionelle Veränderungen einzelner Wirbel sowie von Wirbelketten der oberen Brustwirbelsäule Aura-Symptome auslösen und Migräne-Anfälle induzieren können. Aura-Symptome wie Seh- und Sprachstörungen ebenso wie Sensibilitäts-Störungen, Hemiparesen und Hemiplegien werden in der Regel in die ersten Anfallsphasen der Migräne übernommen. Im weiteren Verlauf kann sich das primäre Anfalls-Muster jedoch auch ändern.
Dies kann auf eine spontane Änderungen der Körperhaltung zurückzuführen sein, vorzugsweise im Bereich der kranio-zervikalen und zerviko-thorakalen Übergänge - zum Beispiel während eines Erbrechens - mit der Folge einer zumindest vorüber gehenden Beeinflussung der präexistenten, symptom-induzierenden Veränderungen der Wirbelketten. Damit werden Topografie und Impulsmuster aktivierter afferenter Neurone, deren spinale Umschaltung, die Zielprojektion sympathischer Neurone und der intrazerebrale Blutfluss verändert und damit das aktuelle Anfallsmuster moduliert.
1. Arbab MA, Wiklund L, Svendgaard NA: Origin and distribution of cerebral vascular innervation from superior cervical, trigeminal and spinal ganglia investigated with retrograde and anterograde WGA-HRP tracing in the rat. Neuroscience. 1986 Nov;19(3):695-708.
The superior cervical, stellate, first and second spinal, and trigeminal ganglia may represent origins of basilar artery innervation. The first and second spinal ganglia projected to the vertebrobasilar arteries, while the ipsilateral part of the internal carotid (outside the circle of Willis) received fibres from the second spinal ganglion. Injection of WGA-HRP into superior cervical ganglion labelled a plexus of nerve fibres on the ipsilateral circle of Willis and the (rostral) basilar artery.
2. Burnstock G: Innervation of vascular smooth muscle: histochemistry and electron microscopy. Clin Exp Pharmacol Physiol. 1975;Suppl 2:7-20.
3. Cabot JB, Alessi V, Carroll J, Ligorio M: Spinal cord lamina V and lamina VII interneuronal projections to sympathetic preganglionic neurons. J Comp Neurol. 1994 Sep 22;347(4):515-30.
Somatic and visceral primary afferent inputs to thoracic spinal cord modify segmental sympathetic preganglionic function. Long-loop propriospinal pathways access sympathetic preganglionic neurons through symmetrical, segmental inter¬neuronal circuitry.
4. Chung K, Chung JM, LaVelle FW, Wurster RD: Sympathetic neurons in the cat spinal cord projecting to the stellate ganglion. J Comp Neurol. 1979 May 1;185(1):23-9.
A wide range (C8-T8) of spinal cord levels projected to the stellate ganglia, with a peak at the T2 level.
5. Dalsgaard CJ, Elfvin LG: The distribution of the sympathetic preganglionic neurons projecting onto the stellate ganglion of the guinea pig. A horseradish peroxidase study. J Auton Nerv Syst. 1981 Nov;4(4):327-37.
Labelled cells were found in the C8-T11 spinal cord segments, The ILp and ILf neurons were mainly located in the T2 and T3 segments, whereas the ICp and ICpe neurons occurred mainly in the T4 to T6 segments.
6. Erdos B, Lacza Z, Toth IE, Szelke E, Mersich T, Komjati K, Palkovits M, Sandor P: Mechanisms of pain-induced local cerebral blood flow changes in the rat sensory cortex and thalamus. Brain Res. 2003 Jan 17;960(1-2):219-27.
During noxious stimulation, cerebral blood flow is adjusted to the increased neural activity by the inter¬action of vaso¬constrictor autoregulatory and specific vasodilator mechanisms, involving the activation of sympathetic beta-receptors, K(+)(ATP)-channels and the release of nitric oxide.
7. Gibbins IL, Hoffmann B, Morris JL: Peripheral fields of sympathetic vasoconstrictor neurons in guinea pigs. Neurosci Lett. 1998 May 29;248(2):89-92.
Typically, 50-100 neurons innervated a region of vasculature 1 mm in diameter. sympathetic vasoconstrictor neurons branch widely before converging on to their target blood vessels.
8. Janig W, Habler HJ: Neurophysiological analysis of target-related sympathetic pathways--from animal to human: similarities and differences. Acta Physiol Scand 2003 Mar;177(3):255-74.
Signals generated by central integration and channelled through the preganglionic neurons into the final sympathetic pathways are precisely transmitted through the para- and prevertebral ganglia and at the neuroeffector junctions to the effector cells. Each type of sympathetic neuron exhibits a discharge pattern that is characteristic for its target cells and, therefore, its function. The similarities of the results obtained in the in vivo studies in the human and in animals justify concluding that the principles of the central organization of sympathetic systems are similar, if not identical, at least in the neuraxis, in both species.
9. Lichtman JW, Purves D, Yip JW: Innervation of sympathetic neurones in the guinea-pig thoracic chain. J Physiol. 1980 Jan;298:285-99.
Neurones in the thoracic chain ganglia, as those in the superior cervical ganglion, are selectively innervated by particular spinal cord segments.
10. Lichtman JW, Purves D, Yip JW: On the purpose of selective innervation of guinea-pig superior cervical ganglion cells. J Physiol. 1979 Jul;292:69-84.
We conclude that on the purpose of the selective connexions in the superior cervical ganglion is to bring together preganglionic axons arising from different levels of the spinal cord and ganglion cells whose axons innervate particular regions of the superior cervical territory.
11. Nagahama M, Kairada K, Ohno S: [Distribution of preganglionic cells of superior cervical ganglion in the spinal cord in the cat]. Nippon Ganka Gakkai Zasshi. 1990 Apr;94(4):359-66.
Labelled cells with HRP [horseradish peroxidase] were found in the intermediolateral nucleus over C8-T6 on the ipsilateral side of the injection. Large number of labelled cells were seen at the T2 and T3 levels, but a few labelled cells were observed at C8, T5 and T6.
12. Olesen J: Headache diagnosis and vascular pathophysiology. Rinsho Shinkeigaku. 1990 Dec;30(12):1317-22.
Vascular mechanism of headache is only known in migraine. The attack begins with occipito-parietal regional cerebral blood flow decrease.
13. Pardini BJ, Wurster RD: Identification of the sympathetic preganglionic pathway to the cat stellate ganglion. J Auton Nerv Syst. 1984 Jul;11(1):13-25.
An average of 9186 neurons were labeled in the spinal cord ipsilateral to the injection from C8 to T9; the highest density of labeling occurred in the first and second thoracic segments.
14. Parker D: Spinal-Cord plasticity: independent and interactive effects of neuromodulator and activity-dependent plasticity. Mol Neurobiol 2000 Aug-Dec;22(1-3):55-80.
Activity-dependent and neuromodulator-mediated plasticity evoke neuron-and synapse-specific effects at different levels in the spinal cord, and that interactions within and between these effects can evoke dynamic changes in cellular, synaptic, and network plasticity.
15. Pilowsky P, Llewellyn-Smith IJ, Minson J, Chalmers J: Sympathetic preganglionic neurons in rabbit spinal cord that project to the stellate or the superior cervical ganglion. Brain Res. 1992 Apr 17;577(2):181-8.
Sympathetic preganglionic neurons that projected to the stellate ganglion were located in spinal segments T1 to T10. Sympathetic preganglionic neurons projecting to the superior cervical ganglion were found in segments T1 to T8. Almost 95% of the neurons supplying the superior cervical ganglion had axons that passed through the stellate ganglion.
16. Piovesan EJ, Kowacs PA, Oshinsky ML: Convergence of cervical and trigeminal sensory afferents. Curr Pain Headache Rep 2003 Oct;7(5):377-83.
Nociceptive information from the trigeminal and cervical territories activates the neurons in the trigeminal nucleus caudalis that extend to the C2 spinal segment and lateral cervical nucleus in the dorsolateral cervical area.These neurons are classified as multimodal because they receive sensory information from more than one afferent type.
17. Rando TA, Bowers CW, Zigmond RE: Localization of neurons in the rat spinal cord which project to the superior cervical ganglion. J Comp Neurol. 1981 Feb 10;196(1): 73-83.
Neurons were found only ipsilateral to the site of HRP application and were restricted to spinal segments C8-T5. Ninety percent of these neurons were located in segments T1-T3.
18. Reuss S, Johnson RF, Morin LP, Moore RY: Localization of spinal cord preganglionic neurons innervating the superior cervical ganglion in the golden hamster. Brain Res Bull. 1989 Feb;22(2):289-93.
Labeled neurons were found only ipsilateral to the injection site in segments C8 to T5 of which the segments T1 to T3 contained about 98% of the labeled cells.
19. Sandor P, Demchenko IT, Kovach AG, Moskalenko YE: Hypothalamic and thalamic blood flow during somatic afferent stimulation in dogs. Am J Physiol. 1976 Jul;231(1): 270-4.
Blood flow changed from 42 +/- 2.1 to 28 +/- 1.7 ml/100 g per min in the thalamus, from 59 +/- 5.0 to 47 +/- 5.0 ml/100 g per min in the hypothalamus, from 21 +/- 1.0 to 17 +/- 0.8 ml/100 g per min in the white matter during ipsilateral stimulation. Contralateral stimulation of the sciatic nerves caused a more moderate but significant drop in rCBF [regional cerebral blood flow]. Tissue aO2 decreased by 25 +/- 2% in the thalamic and by 19 +/- 2% in the hypothalamic area, relative to the pre¬stimulation level.
20. Sato T, Sato S, Suzuki J: Correlation with superior cervical sympathetic ganglion and sympathetic nerve innervation of intracranial artery - electron microscopical studies. Brain Res. 1980 Apr 21;188(1):33-41.
The distribution of adrenergic nerve fibers from the superior cervical ganglion is bilateral in the anterior cerebral artery from the anterior communicating artery to the peripheral region, basilar artery, and vertebral artery, but ipsilateral only in the anterior cerebral artery as far as the anterior communicating artery, middle cerebral artery, posterior communicating artery, posterior cerebral artery and superior cerebellar artery.
21. Skyhoj Olsen T, Lassen NA: Blood flow and vascular reactivity during attacks of classic migraine - limitations of the Xe-133 intraarterial technique. Stroke. 1994 May; 25(5):974-9.
During migraine with aura attacks cerebral blood flow (CBF) appears to decrease focally in the posterior part of the brain which is consistent with a mild degree of ischemia. In most cases true CBF may change 50% or more in the low flow areas without giving rise to significantly measurable changes of CBF.
22. Thomsen LL, Iversen HK, Olesen J: Cerebral blood flow velocities are reduced during attacks of unilateral migraine without aura. Cephalalgia. 1995 Apr;15(2):109-16.
Blood velocity in the middle cerebral artery was lower on the headache side (59 cm/s) than on the non-headache side (65 cm/s) during the migraine attack.
23. Yamamoto K, Senba E, Matsunaga T, Tohyama M: Calcitonin gene-related peptide containing sympathetic preganglionic and sensory neurons projecting to the superior cervical ganglion of the rat. Brain Res. 1989 May 15;487(1):158-64.
Labelled neurons were observed in the C8-T5 spinal cord segments, with the highest density in T1-T3. A few FB-labeled cells [injection of Fast blue] were also observed in dorsal root ganglia (C8-T5).
24. Yau JI, Wu JJ, Liu JC: Origins of the afferent fibers to the cat superior cervical ganglion. Proc Natl Sci Counc Repub China B. 1991 Feb;15(1):1-7.
We found that the preganglionic neurons were located in the spinal segments C8-T5, particularly in T1-T3.
Wissenschaftliche Belege
Migräne-Aura
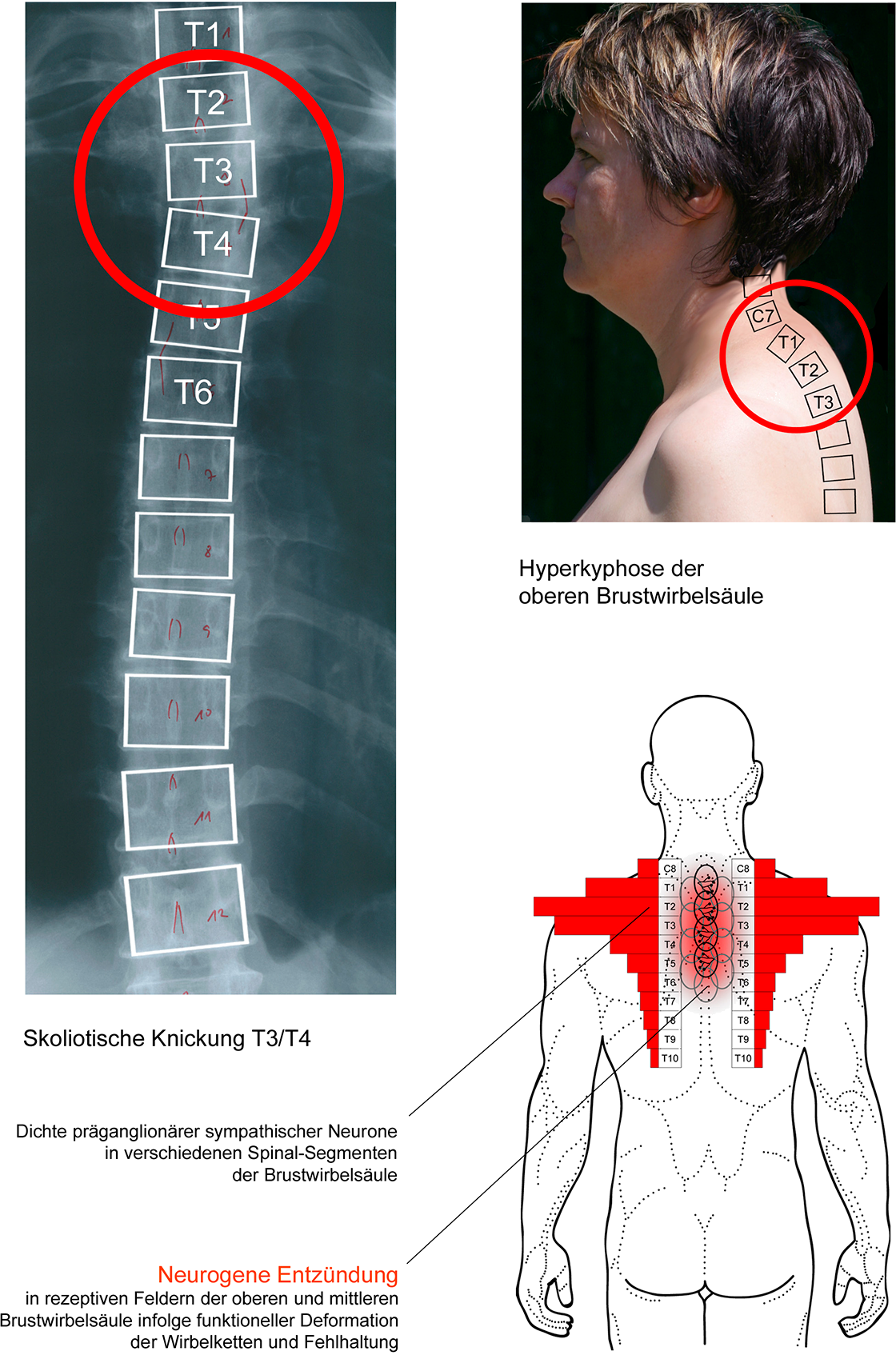
Aura-Symptomen wie Seh- und Sprachstörungen, Sensibilitäts-Störungen an Armen und Beinen sowie Hemiplegien können funktions-pathologische Veränderungen im Bereich der oberen Brustwirbelsäule zugeordnet werden.
Präganglionäre Fasern des Ggl. cervicale superius entstammen zum größten Teil den Thorakal-Segmenten T1 bis T3 [11,20,22,30]. Postganglionäre noradrenerge Neurone aus diesem Ganglion innervieren alle drei Hirnarterien [24,28].
Während der Migräne-Aura und in der Initialphase der Migräne wurde eine fokale Reduktion des zerebralen Blutflusses beobachtet [8,9,14] bei erhaltener Autoregulation [13].
Wenn aura- und anfallsbegleitende Veränderungen des zerebralen Blutverteilungsmusters bei im Übrigen erhaltener Autoregulation erfolgen, liegt der Gedanke nahe, extrakranielle Vorgänge hierfür in Anspruch zu nehmen unter besonderer Berücksichtigung der beschriebenen topografisch-anatomischen Zusammenhänge.
Daher könnten Initialisierungs-Mechnismen aus den peripheren präganglionären Projektionsfeldern des Ggl. cervicale superius stammen und die betroffenen „Sammelstellen“ proprio- und nozizeptiver Konvergenz, vorrangig die Thorakal-Segmente T1 bis T3, eine herausragende Bedeutung in der Pathogenese der Migräne-Aura erlangen.
Das Ggl. stellatum, entstanden aus der Verschmelzung des untersten Cervical- mit den oberen Thorakal-Ganglien 1 und 2, hat seine frühere Bedeutung für Prophylaxe und Akutbehandlung der Migräne weitgehend verloren, da der Aufwand für in herkömmlicher Technik durchgeführter Blockaden seit Einführung der Triptane in die Akutbehandlung der Migräne in keiner vertretbaren Relation zu Risiko und Nutzen mehr stand.
Da jedoch andererseits die im Stellatum umgeschalteten postganglionären sympatischen Neurone die Perfusionsverhältnisse im Hirnstamm maßgeblich beeinflussen können, sind Blockaden des Ggl. stellatum zu Prophylaxe und Therapie der Migräne-Aura neu zu bewerten, sofern deren Applikation in risikoarmer, nebenwirkungsfreier und Patienten nicht belastender Technik und Pharmakologie durchgeführt werden.
Die dafür erforderliche spezielle Technik und Vorgehensweise einschließlich der sehr wichtigen patentierten pharmakologischen Komponente haben wir entwickelt (siehe unter "Methoden") und können damit Migräne-Auren spontan löschen und mit Repetition der Blockaden auch prophylatisch verhindern.
Fall-Beispiel der Spontan-Remission einer bis dato Therapie-resistenten intraiktalen Gangstörung nach Stellatum-Blockade im T2-Segment mit neuer Technik und Pharmakologie:
Die Frühphase der Migräne-Aura ist gekennzeichnet durch eine „Spreading depression“ [2,6,25], die sich von posterior nach anterior ausbreitet [1,16], mit Ischämiezonen [17,26] im Versorgungsgebiet der A. cerebri posterior beginnt [4], dort die Sehrindenfelder trifft unter Auslösung halluzinoider Sehstörungen [19,23], um sich dann auf die Versorgungsgebiete der A. cerebri anterior und media auszubreiten [15], in denen die somatomotorischen und sensomotorischen Rindenfelder liegen, woraus sich Sensibilitäts-Störungen sowie Hemiparesen, seltener auch Hemiplegien entwickeln können. Je nach Lage der Ischämiezonen werden Hirnfunktionen in unterschiedlicher Ausprägung, Intensität und Topografie getroffen.
Sehstörungen können auch als geringgradige Gesichtsfeld-Einschränkungen oder -Trübungen imponieren oder als transiente Amaurosen auftreten und sind für die Migräne-Aura obligat (90%), Sprachstörungen sowie sensorische oder motorische Störungen allein ohne Sehstörungen wurden dagegen eher selten beobachtet [21].
Lokalisation und Ausdehnung neurogener Entzündungen in rezeptordichten rezeptiven Feldern wirbelsäulennaher Gewebe bestimmen nach dem Prinzip der neuro-neuronalen Ziel-projektion die Topografie der im Ggl. cervicale superius einlaufenden präganglionären Neurone, die dort konvergent auf postganglionäre Neurone umgeschaltet [27] ihre Zielgebiete erreichen.
Damit stehen immer definierte periphere Gewebsareale mit intrakraniellen Zielstrukturen in definierten Gefäßabschnitten [5] in direkter neuro-neuronaler Verbindung.
Danach ist es vorstellbar, dass eine schrittweise Ausdehnung neurogener Entzündungen in peripheren rezeptiven Feldern zur schrittweisen Ausbreitung und Ausdehnung intrazerebraler Ischämiezonen nach dem Muster der „Spreading depression“ unter Ausbildung von Sehstörungen führen kann sowie weiterer neurologischer Defizite [1]. Ausgangspunkt dieser Entwicklung sind nach vorliegenden klinischen Daten die Thorakal-Etagen T1 und T2, seltener T3.
Diese aus Verlaufsbeobachtungen nach Blockaden thorakaler Grenzstrang-Ganglien gewonnenen Daten korrelieren mit topografisch-anatomischen Daten [12] sowie Angaben über die Dichte präganglionärer sympathischer Neurone, die zum Ggl. cervicale superius projezieren [11,20,22,30]. Diese Angaben wiederum korrelieren mit der klinischen Relevanz funktions-pathologischer Veränderungen im Bereich der oberen Brustwirbelsäule, die damit ihrerseits mit Ausbildung und Dynamik von Ischämie-Zonen einer „Spreading depression“ korrelieren.
Hierin schließt sich der Kreis, insoweit der „Spreading depression“ die Entwicklung der Aura-Symptome zu Recht zugeschrieben werden kann [1,2,6,16,25].
Damit ist die Annahme, wonach die Aura-Genese primär von Mechanismen aus der oberen Brustwirbelsäule definiert wird, zwingend und methodisch zu belegen:
Durch Blockaden der wirbelsäulennahen Strukturen der Thorakal-Segmente T1 und T2 (seltener T3) inclusive deren Grenzstrang-Ganglien können sämtliche Aura-Symptome spontan abortiert werden. Individuell nachfolgende Migräne-Anfälle bleiben darunter obligat suspendiert.
1. Baron JC: [The pathophysiology of migraine: insights from functional neuroimaging]. Rev Neurol (Paris). 2000;156 Suppl 4(4):15-23.
The migraine aura is characterized by the occurrence of an hypoperfusion of moderate intensity which is peculiar by its initial appearance in the posterior cortex and its anterior spread at a speed of about 2 to 3mm per minute, congruent with the migrainous march of neurologic deficit and reminiscent of the phenomenon of cortical spreading depression.
2. Bowyer SM, Aurora KS, Moran JE, Tepley N, Welch KM: Magnetoencephalographic fields from patients with spontaneous and induced migraine aura. Ann Neurol. 2001 Nov;50(5):582-7.
The migraine aura is characterized by the occurrence of an hypoperfusion of moderate intensity which is peculiar by its initial appearance in the posterior cortex and its anterior spread at a speed of about 2 to 3mm per minute, congruent with the migrainous march of neurologic deficit and reminiscent of the phenomenon of cortical spreading depression.
3. Chou PI, Shaw KP, Liu JC, Lu DW: Origin of innervation in the feline ophthalmic artery. Ophthalmologica. 1999;213(1):54-7.
The feline ophthalmic artery is innervated by the ipsilateral trigeminal and superior cervical ganglia.
4. Cutrer FM, O‘Donnell A, Sanchez del Rio M: Functional neuroimaging: enhanced understanding of migraine pathophysiology. Neurology. 2000;55(9 Suppl 2):36-45.
Despite conflicting findings, migraine with visual aura appears to be generally associated with transient decreases in regional cerebral blood flow. Neurons in the occipital cortex are hyperexcitable, predisposing patients to develop aura symptoms.
5. Gibbins IL, Hoffmann B, Morris JL: Peripheral fields of sympathetic vasoconstrictor neurons in guinea pigs. Neurosci Lett. 1998 May 29;248(2):89-92.
Typically, 50-100 neurons innervated a region of vasculature 1 mm in diameter. sympathetic vasoconstrictor neurons branch widely before converging on to their target blood vessels.
6. Hadjikhani N, Sanchez Del Rio M, Wu O, Schwartz D, Bakker D, Fischl B, Kwong KK, Cutrer FM, Rosen BR, Tootell RB, Sorensen AG, Moskowitz MA: Mechanisms of migraine aura revealed by functional MRI in human visual cortex. Proc Natl Acad Sci U S A. 2001 Apr 10;98(8):4687-92.
These data strongly suggest that an electrophysiological event such as cortical spreading depression generates the aura in human visual cortex.
7. Higa S: [Migraine and nerve block]. Nippon Rinsho. 2001 Sep;59(9):1717-21.
Stellate ganglion block is a usefulness of amelioration of the sensory nerves of the intracranial vessels and prevention of migraine headache.
8. La Spina I, Calloni MV, Porazzi D: Transcranial Doppler monitoring of a migraine with aura attack from the prodromal phase to the end. Headache. 1994 Nov-Dec;34(10): 593-6.
All these findings suggest a focal reduction in cerebral blood flow in the prodromic phase.
9. Meyer JS, Terayama Y, Takashima S, Obara K: Cerebral circulatory changes during migraine headache with aura. Rev Neurosci. 1993 Jul-Sep;4(3):305-19.
Regional cerebral blood flow has been decreased during the prodromal phase and increased during and immediately after the headache phase of migraine attacks. Abnormal vascular responsiveness has been demonstrated, not only during each attack, but also between attacks.
10. Mineta Y, Morimoto M, Harano K, Totoki T: [Sympathetic postganglionic innervation of external carotid artery, internal carotid artery, common carotid artery and aorta in the dog--experimental study using HRP and WGA-HRP]. Masui 1992 Apr;41(4):547-53.
The vasodilation of the head and neck after stellate ganglion block using local anesthetic agents is caused by neuronal block of preganglionic sympathetic fibers passing through the stellate ganglion and terminating in the superior cervical ganglion.
11. Nagahama M, Kairada K, Ohno S: [Distribution of preganglionic cells of superior cervical ganglion in the spinal cord in the cat]. Nippon Ganka Gakkai Zasshi. 1990 Apr;94(4):359-66.
Labelled cells with HRP [horseradish peroxidase] were found in the intermediolateral nucleus over C8-T6 on the ipsilateral side of the injection. Large number of labelled cells were seen at the T2 and T3 levels, but a few labelled cells were observed at C8, T5 and T6.
12. Netter FH: Farbatlanten der Medizin. Bd 5: Nervensystem I. Neuroanatomie und Physiologie. Georg Thieme Verlag Stuttgart, New York.1987;75.
Die präganglionären Sympathicusfasern für das Sehorgan kommen aus dem gleichseitigen 1. und 2., mitunter auch 3. thorakalen Spinalnerven.
13. Olesen J: Headache diagnosis and vascular pathophysiology. Rinsho Shinkeigaku. 1990 Dec;30(12):1317-22.
Vascular mechanism of headache is only known in migraine. The attack begins with occipito-parietal regional cerebral blood flow decrease. The autoregulation, however, seems to be preserved.
14. Olesen J, Friberg L, Olsen TS, Iversen HK, Lassen NA, Andersen AR, Karle A: Timing and topography of cerebral blood flow, aura, and headache during migraine attacks. Ann Neurol. 1990 Dec;28(6):791-8.
Unilateral headache usually localized to the side on which regional cerebral blood flow was reduced and from which the aura symptoms originated.
15. Olesen J: Cerebral and extracranial circulatory disturbances in migraine: pathophysiological implications. Cerebrovasc Brain Metab Rev. 1991 Spring;3(1):1-28.
In the early phase of an attack, migraine with aura is associated with posterior focal hypoperfusion in one hemisphere. This spreads forward, usually to involve the posterior one-third to one-half of a hemisphere.
16. Olesen J: Regional cerebral blood flow (rCBF) studies in migraine and epilepsy. Funct Neurol. 1986 Oct-Dec;1(4):369-74.
Aura symptoms are associated with reduced cerebral blood flow. The reduction usually starts posteriorly and spreads gradually anteriorly.
17. Olsen TS, Friberg L, Lassen NA: [Migraine aura - vascular or neuronal disease?] Ugeskr Laeger. 1990 May 21;152(21):1507-9.
Persistent neurological deficits, EEG abnormalities and infarcts on CT-scans are seen after MA, thus further supporting the theory of vascular dysfunction (vasospasm) and ischemia as the cause of the migraine-aura.
18. Pilowsky P, Llewellyn-Smith IJ, Minson J, Chalmers J: Sympathetic preganglionic neurons in rabbit spinal cord that project to the stellate or the superior cervical ganglion. Brain Res. 1992 Apr 17;577(2):181-8.
Sympathetic preganglionic neurons that projected to the stellate ganglion were located in spinal segments T1 to T10. Sympathetic preganglionic neurons projecting to the superior cervical ganglion were found in segments T1 to T8. Almost 95% of the neurons supplying the superior cervical ganglion had axons that passed through the stellate ganglion.
19. Queiroz LP, Rapoport AM, Weeks RE, Sheftell FD, Siegel SE, Baskin SM: Characteristics of migraine visual aura. Headache. 1997 Mar;37(3):137-41.
The most common phenomena described were: small bright dots (42%), flashes of light (39%), „blind spots“ (32%), and „foggy vision“ (27%). Fortification spectra was reported by only 20%.
20. Rando TA, Bowers CW, Zigmond RE: Localization of neurons in the rat spinal cord which project to the superior cervical ganglion. J Comp Neurol. 1981 Feb 10;196(1):73-83.
Neurons were found only ipsilateral to the site of HRP application and were restricted to spinal segments C8-T5. Ninety percent of these neurons were located in segments T1-T3.
21. Rasmussen BK, Olesen J: Migraine with aura and migraine without aura: an epidemiological study. Cephalalgia. 1992 Aug;12(4):221-8; discussion 186.
Visual disturbances were the most common aura phenomenon occurring in 90% of subjects with migraine with aura. Aura symptoms of sensory, motor or speech disturbances rarely occurred without coexisting visual disturbances.
22. Reuss S, Johnson RF, Morin LP, Moore RY: Localization of spinal cord preganglionic neurons innervating the superior cervical ganglion in the golden hamster. Brain Res Bull. 1989 Feb;22(2):289-93.
Labeled neurons were found only ipsilateral to the injection site in segments C8 to T5 of which the segments T1 to T3 contained about 98% of the labeled cells.
23. Sakai F: [Regional cerebral blood flow during migraine]. Rinsho Shinkeigaku. 1995 Dec;35(12):1333-5.
During the aura of scintillation scotoma in the unilateral visual field regional cerebral blood flow was reduced in the opposite occipital, temporal and thalamic regions which corresponded clearly to the region of the posterior cerebral arterial territory. The primary site of regional cerebral blood flow reduction during the visual aura is the occipital association cortex which is reported to be responsible for the visual hallucination.
24. Sato T, Sato S, Suzuki J: Correlation with superior cervical sympathetic ganglion and sympathetic nerve innervation of intracranial artery - electron microscopical studies. Brain Res. 1980 Apr 21;188(1):33-41.
The distribution of adrenergic nerve fibers from the superior cervical ganglion is bilateral in the anterior cerebral artery from the anterior communicating artery to the peripheral region, basilar artery, and vertebral artery, but ipsilateral only in the anterior cerebral artery as far as the anterior communicating artery, middle cerebral artery, posterior communicating artery, posterior cerebral artery and superior cerebellar artery.
25. Shibata K, Osawa M, Iwata M: Pattern reversal visual evoked potentials in migraine with aura and migraine aura without headache. Cephalalgia. 1998 Jul-Aug;18(6):319-23.
Cortical spreading depression remains the most likely explanation for the migraine visual aura.
26. Skyhoj Olsen T, Lassen NA: Blood flow and vascular reactivity during attacks of classic migraine - limitations of the Xe-133 intraarterial technique. Stroke. 1994 May; 25(5):974-9.
During migraine with aura attacks cerebral blood flow (CBF) appears to decrease focally in the posterior part of the brain which is consistent with a mild degree of ischemia. In most cases true CBF may change 50% or more in the low flow areas without giving rise to significantly measurable changes of CBF.
27. Tatarchenko LA: [Convergence of preganglionic fibers on neurons of the rabbit superior cervical ganglion]. Neirofiziologiia. 1989;21(2):252-61.
8.5 +/- 1.2 fibres, on the average, converged on each cell. each ganglionic neuron received two preganglionic inputs: single and multiple. The multiple input was formed by two or more converging preganglionic fibres.
28. Tsai SH, Lin SZ, Wang SD, Liu JC, Shih CJ: Retrograde localization of the inner¬vation of the middle cerebral artery with horseradish peroxidase in cats. Neurosurgery. 1985 Apr;16(4):463-7.
The innervation of the middle cerebral artery originate in the ipsilateral superior cervical ganglion.
29. Ullrich J: [Stellate ganglion block under EEG control in the treatment of complicated cervical migraine]. Neurol. 1975 Aug 1;209(4):301-6.
A transient amelioration of the pathological EEG pattern was observed after each stellate ganglion block and after several treatments the EEG was normal and the migraine attacks disappeared.
30. Yamamoto K, Senba E, Matsunaga T, Tohyama M: Calcitonin gene-related peptide containing sympathetic preganglionic and sensory neurons projecting to the superior cervical ganglion of the rat. Brain Res. 1989 May 15;487(1):158-64.
Labelled neurons were observed in the C8-T5 spinal cord segments, with the highest density in T1-T3. A few FB-labeled cells [injection of Fast blue] were also observed in dorsal root ganglia (C8-T5).
Wissenschaftliche Belege
Publikation
12. Schmerz-Weltkongress Glasgow 2008
„Wirksame Behandlung von Migräne-Schmerzen und Begleit-Symptomen bei chronischer Migräne durch wiederholte zerviko-thorakale Sympathicus-Blockaden mit hohen Volumina von niedrig dosiertem Lidocain in Ringer-Lösung.“
Ziele der Untersuchung
Migräne und ihre Begleitsymptome sind durch sensorische, autonome (sympathisch / parasympathische) sowie verschiedene intrazerebrale neurovaskuläre Veränderungen gekennzeichnet [2,4,6,8,10].
Die Verabreichung von ß-Blockern kann Migräne-Anfälle verhindern bzw. reduzieren [9]. Dies deutet auf eine ursächliche Beteiligung des sympathischen Nervensystems (SNS) an der komplexen Pathophysiologie der Migräne. Das SNS spielt auch eine wichtige Rolle bei neuropathischen Schmerzen durch sympathisch-sensorische neuro-immune Wechselwirkungen.
Migräne besitzt Merkmale neuro-pathischer Schmerzen; Medikamente gegen Migräne können gegen neuropathische Schmerzen wirksam sein [1,3].
Stimulation der Nn. occipitalis wirkt Migräne und anderen Kopfschmerzen entgegen [5]. Lidocain hemmt die durch NFkB vermittelte Produktion von Zytokinen aus Entzündungszellen [7].
Vor diesem Hintergrund erscheint es sinnvoll, die Migräne assoziierte Fehlfunktion des SNS durch dorsale Sympathicus-Blockaden (Abb. 1) zu behandeln, um damit Migräne, Migräne-Aura und ihre Begleitsymptome zu lindern.
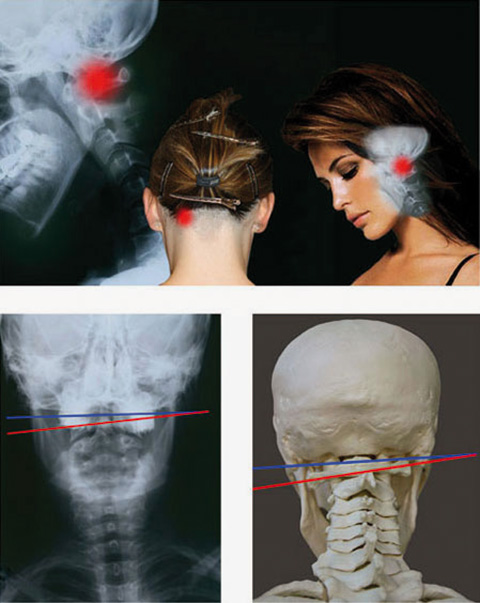
Röntgenaufnahmen der oberen Halswirbelsäule zeigen vor und während eines Migräne-Anfalls den ersten Halswirbel in der Regel geneigt und gleichzeitig gedreht (Abb. 2 und 3), meistens zur Seite der Migräne-Schmerzen (>70%). Am gleichseitigen Proc. transversus des Wirbels können regelmäßig starke Schmerzen provoziert werden.
Wir nehmen an, dass diese Schmerzen aufgrund örtlicher Entzündungen entstehen infolge der Wirbeldistorsion mit Muskelverspannungen, die sensorisch-sympathische neuro-immune Reaktionen nach sich ziehen.
Migräne-Patienten weisen häufig funktionelle Veränderungen der oberen Brustwirbelsäule auf, die primär schmerzhaft sind oder in deren Bereich Schmerzen provoziert werden können (Abb. 4a und 4b), von denen wir annehmen, dass sie die Symptome der Migräne-Aura wie z.B. Sehstörungen hervorrufen (Abb. 1 - 4).
Wir stellen hier die Hypothese auf, dass Sympathicus-Blockaden wirksam sein sollten bei der Behandlung von Migräne und Migräne-Aura und erwarten zusammen mit speziellen Anweisungen für Migräne-Patienten zur Verbesserung ihrer statischen und dynamischen Körperhaltung und ihrer allgemeinen Lebensführung einen lang anhaltenden therapeutischen Effekt von mindestens einigen Jahren.
Methoden
Unter Anwendung der diagnostischen Kriterien der IHS (2003) wurden 84 Patienten mit chronischer Migräne in eine retrospektive Analyse einbezogen. 69 Patienten (81%) waren weiblich, 15 (19%) waren männlich. Das Durchschnittsalter betrug 46,1 Jahre, das Intervall 18 - 76 Jahre.
43 Patienten (51% von allen) litten an Migräne, 31 (37% von allen) litten an Migräne mit Aura, 53 Patienten (63% von allen) litten an Migräne ohne Aura.
Die durchschnittliche Krankheitsdauer betrug 22,9 Jahre (2 - 62) mit 7,4 Migräne-Anfällen (3 - 10) pro Monat mit einer durchschnittlichen Dauer von 52,0 Stunden (2 - 216) und einer Schmerz-Intensität auf dem Höhepunkt eines Anfalls von durchschnittlich 8,5 Punkten innerhalb einer 10-Punkte-Skala.
41 Patienten (49% von allen) litten sowohl an Migräne als auch an Kopfschmerzen vom Spannungstyp.
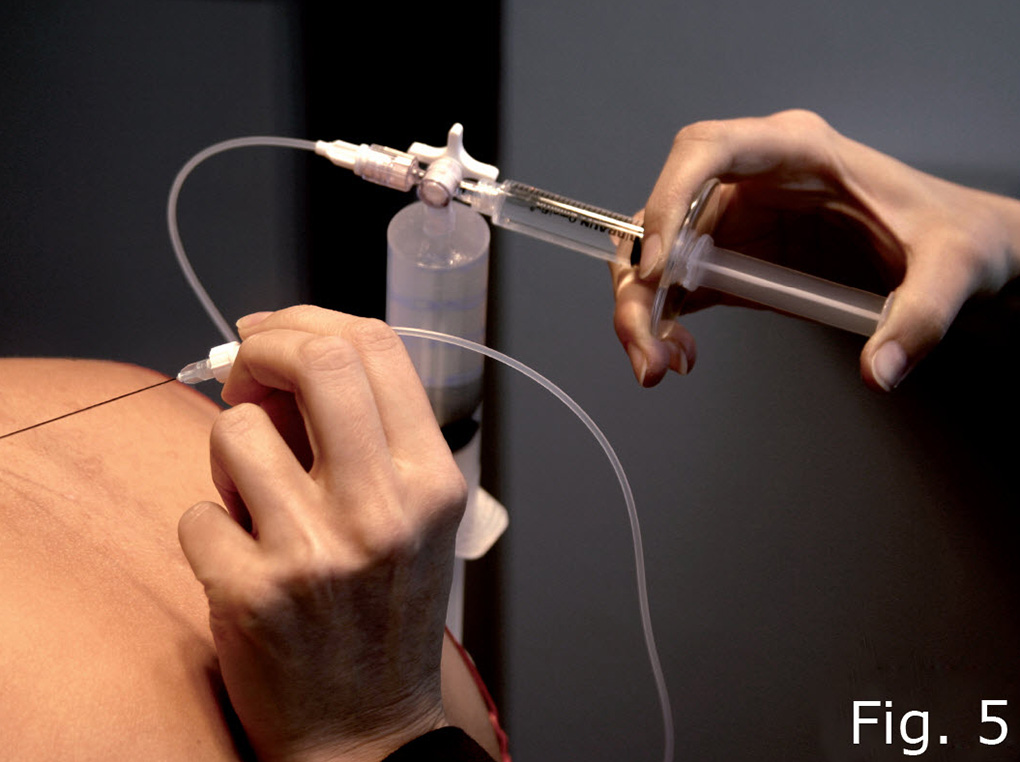
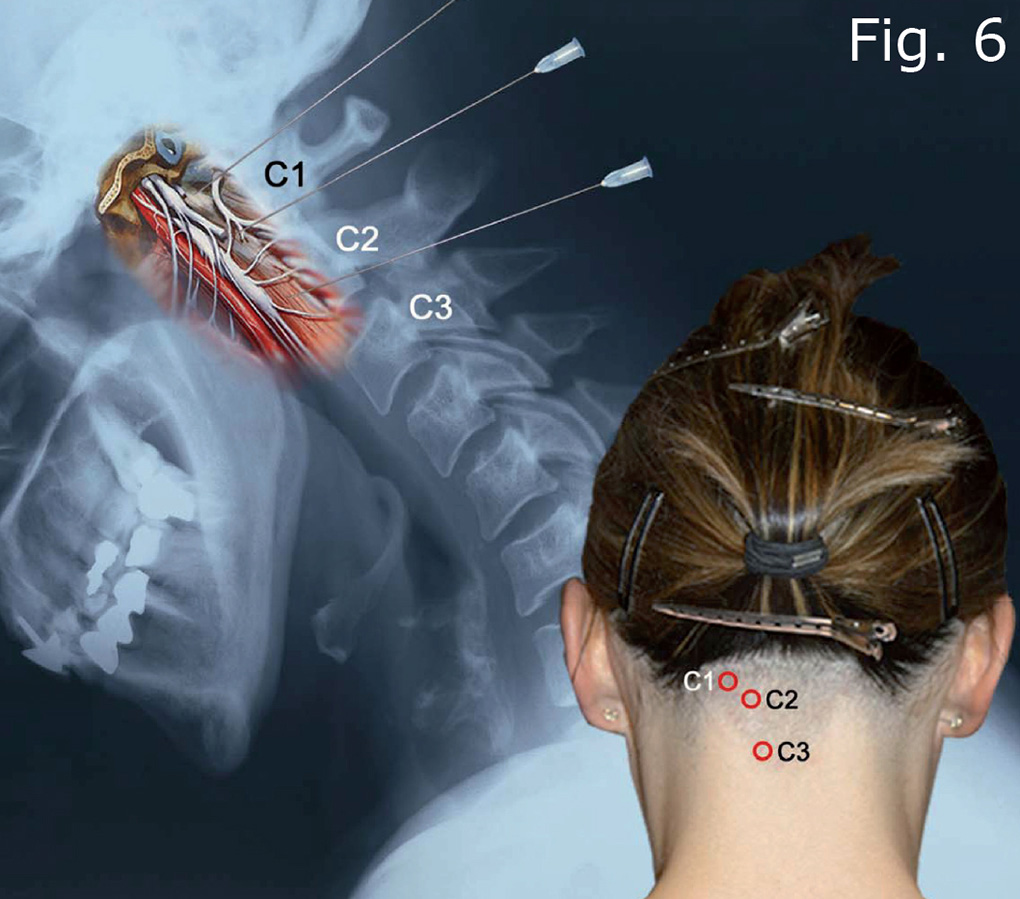
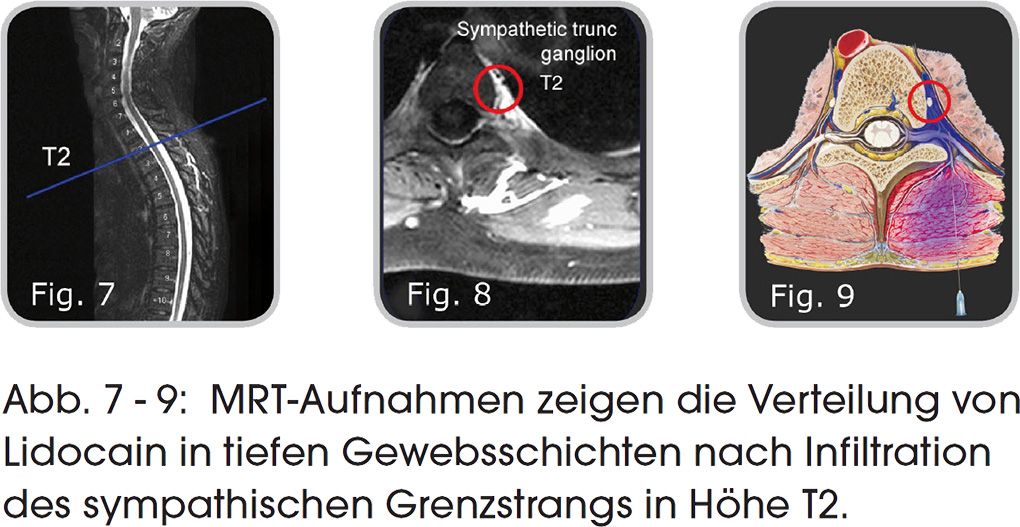
Mit einer neu konzipierten speziellen Apparatur (Abb. 5) wurden wiederholte Sympathicus-Blockaden gesetzt, standardmäßig mittels tiefer dorsaler zerviko-thorakaler Infiltration (Abb. 6) mit niedrig dosiertem Lidocain in Ringer-Lösung in einer Konzen-tration zwischen 0,025% und 0,2 % mit einem Volumen von 6 - 24 ml pro Infiltration. Zur Vermeidung von Gewebsverletzungen wurden die Kanülen grundsätzlich unter konstanter Flüssigkeitsabgabe in das Gewebe vorgeschoben (Abb. 9).
Die Patienten wurden innerhalb von 4 (n=21), 5 (n=43) und 6 (n=20) Wochen täglich morgens und abends während einer Migräne-Aura und eines Migräne-Anfalls sowie während der anfallsfreien Perioden behandelt ohne Verwendung anderer Medikamente. Vorangegangene Medikation wurde vor Behandlungsbeginn abgesetzt.
Mit einem standardisierten Fragebogen auf der Basis von visuellen Analog-Skalen mit 10 Punkten für die höchste Intensität von Symptomen (Abb. 10) wurde das Anfangsstadium vor Eintritt in die Behandlung erfasst und die Therapiewirkungen kontrolliert.
Insgesamt wurden 36 Migräne-Schmerzen und Migräne-Begleitsymptome vor und nach jeder Behandlung zweimal pro Tag dokumentiert (prä- und posttherapeutisch) zur engmaschigen Kontrolle des Behandlungsverlaufs während der gesamten Behandlungs-Periode.
Diese Daten wurden mit den Ergebnissen des formal identischen Bogens „0“ verglichen, den Patienten vor Beginn ihrer Behandlung ausfüllen mussten und der ihren letzten schweren Migräne-Anfall ohne Einsatz von Medikamenten abbildete. Die Veränderung der Summe aller Schmerz-Intensitäten und Migräne-Begleitsymptome diente als Maßstab für die Wirksamkeit der Behandlung zusammen mit dem Rückgang der Kopfschmerz-Frequenz und der Migräne-Anfälle.

Ergebnisse
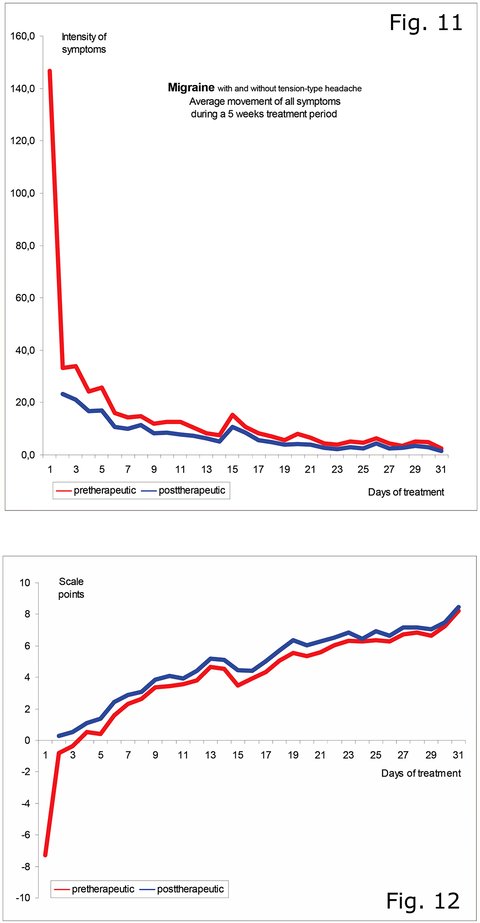
Die Gesamtsummen aller Intensitäten von Schmerzen und Begleitsymptomen im Migräne-Anfall zeigten unter der Behandlung einen übereinstimmenden Rückgang in allen Behandlungs-Perioden von 4 oder 5 Wochen auf weniger als 10% am Ende der ersten Woche (Abb. 11) und eine entsprechend positive Zunahme des Allgemeinbefindens (Abb. 12).
Die 4-wöchige Behandlungs-Gruppe erreichte am Ende einen Intensitäts-Rückgang aller Schmerzen und Begleitsymptome auf 3,2%.
Die über 5 bzw. 6 Wochen behandelten Gruppen erreichten einen Rückgang auf 1,1% beziehungsweise 1,0% gegenüber den jeweiligen Intensitäten zu Behandlungs-Beginn. Migräne-Aura und Migräne-Anfälle konnten regelmäßig innerhalb von 5 bis 10 Minuten nach den Infiltrationen durchbrochen werden.
Kopfschmerzen vom Spannungs-Typ wurden gleichzeitig schrittweise bis zum Ende jeder Behandlungs-Periode beseitigt.
Schlussfolgerungen
Diese Ergebnisse zeigen die hohe Wirksamkeit der wiederholten zerviko-thorakalen Sympathicus-Blockaden bei chronischen Migränikern, die gegenüber konventionellen Pharmako-Therapien resistent sind. Die dem Therapieerfolg zugrunde liegenden Mechanismen umfassen:
- die Rückgewinnung des gestörten Gleichgewichts der komplexen Einstellungen sympathischer Co-Transmitter einschließlich von Prostaglandinen, ATP, Adenosin, NO und verschiedener Neuropeptide
- die Neueinstellung der gestörten langschleifigen sympathisch-trigeminalen und sympathisch-parasympathischen Wechselbeziehungen
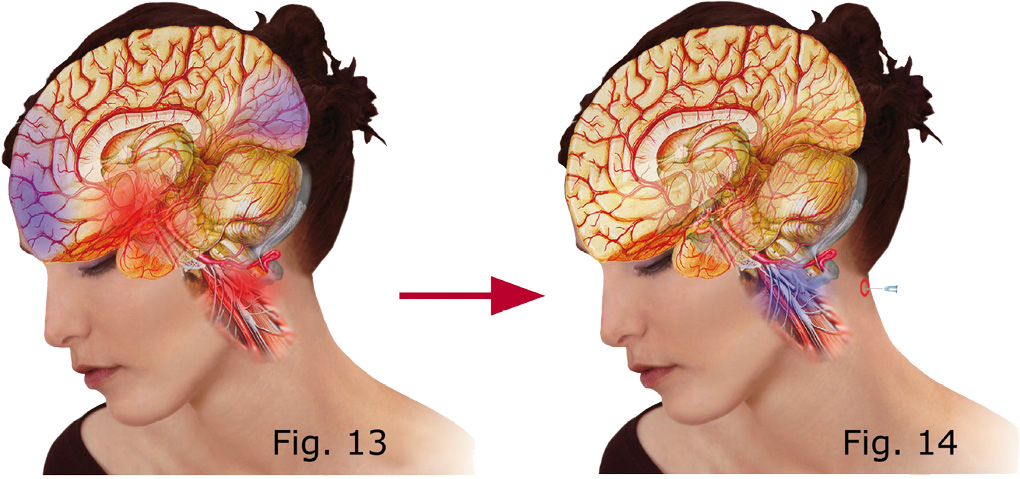
- die örtliche Hemmung der Nervenerregung und den anti-inflammatorischen Einfluss des Lidocain in tiefen zerviko-thorakalen sympathisch-sensorischen neuro-immunen und neuro-muskulären Trigger-Regionen von Migräne und Migräne-Aura (Abb. 13, 14).